1/5ページ
ダウンロード(1.3Mb)
マスターセルバンク(MCB)テストとエンドオブ プロダクションセルバンク(EoPC)テスト
CHO細胞は製薬業界で最も広く使用されている生産細胞株で、安全性プロファイルも20年以上にわたって確立されてきています。CHO生産細胞株の安全性と特性解析に関するガイドラインは、医薬品規制調和国際会議(ICH)Q5(R1)「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品のウイルス安全性評価」と、ICH Q5D「生物薬品(バイオテクノロジー応用医薬品 | 生物起源由来医薬品)製造用細胞基剤の由来、調製及び特性解析」に調和されました。
◆続きはカタログをダウンロードし、ご覧下さい。
このカタログについて
| ドキュメント名 | チャイニーズハムスター 卵巣(CHO)細胞セルバンク安全性試験と特性解析 |
|---|---|
| ドキュメント種別 | 製品カタログ |
| ファイルサイズ | 1.3Mb |
| 取り扱い企業 | ザルトリウス・ジャパン株式会社 (この企業の取り扱いカタログ一覧) |
この企業の関連カタログ

このカタログの内容
Page1
チャイニーズハムスター
卵巣(CHO)細胞
セルバンク安全性試験
と特性解析
Page2
チャイニーズハムスター マスターセルバンク(MCB)テストとエンドオブ
卵巣(CHO)細胞セルバンク プロダクションセルバンク(EoPC)テスト
安全性試験と特性解析 GMP適合製品の製造には、まずマスターセルバンク(MCB) MCBテストは1回実施します。エンドオブプロダクションセルバ
を作製しなければなりません。MCBはクローン細胞集団から ンク(EoPC)では、細胞が原細胞から変化していないかを判
CHO細胞は製薬業界で最も広く使用されている生産細胞株で、安全性プロファイルも 均一に増殖された細胞株で、凍結用チューブに均質に分注さ 断し、MCBに存在はしていても検出されない可能性のある低
20年以上にわたって確立されてきています。CHO生産細胞株の安全性と特性解析に関 れ、細胞株の最初の拡大培養を担い広範囲に及ぶ特性解析を レベルの汚染を検出するため、ほぼ同様で若干種類の少ない
するガイドラインは、医薬品規制調和国際会議(ICH)Q5(R1)「ヒト又は動物細胞株を 必要とします。すべてのワーキングセルバンク(WCB)は完成し テストパッケージが繰り返されます。また、EoPCを検査するこ
用いて製造されるバイオテクノロジー応用医薬品のウイルス安全性評価」と、ICH Q5D たMCBから作製されます。外因性ウイルス、内在性ウイルスに とで、潜伏感染や製造工程で混入した汚染物質も検出するこ
「生物薬品(バイオテクノロジー応用医薬品 | 生物起源由来医薬品)製造用細胞基剤の
よる汚染の有無を問う広範なスクリーニングに加え、微生物汚 とができます。生産に使用されたEoPCテストは製品許可申請
由来、調製及び特性解析」に調和されました。
染の有無を調べるテストも実施する必要があります。 (PLA)の提出前に実施する必要があります。MCBとEoPCに
2007年以降、ザルトリウスは200件以上のチャイニーズハムスター卵巣(CHO)細胞セ 要求されるテスト概要を表2に示します。
ルバンクの安全性及び特性解析試験を実施してきました。当社研究者は豊富な知識と
経験を有しており、化学や規制上の要件に適合する最適かつ費用対効果の高い試験戦
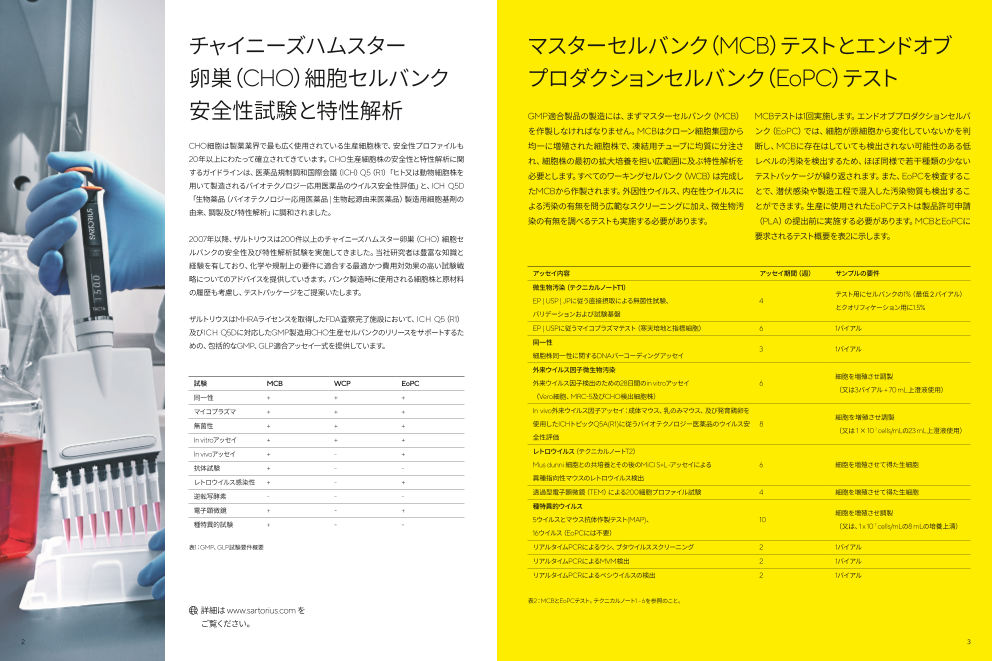
アッセイ内容 アッセイ期間(週) サンプルの要件
略についてのアドバイスを提供していきます。バンク製造時に使用される細胞株と原材料
の履歴も考慮し、テストパッケージをご提案いたします。 微生物汚染(テクニカルノートT1)
テスト用にセルバンクの1%(最低2バイアル)
EP | USP | JPに従う直接摂取による無菌性試験、 4
とクオリフィケーション用に1.5%
ザルトリウスは バリデーションおよび試験基盤
MHRAライセンスを取得したFDA査察完了施設において、ICH Q5(R1)
及びICH Q5Dに対応したGMP製造用CHO生産セルバンクのリリースをサポートするた EP | USPに従うマイコプラズマテスト(寒天培地と指標細胞) 6 1バイアル
めの、包括的なGMP、GLP適合アッセイ一式を提供しています。 同一性
3 1バイアル
細胞株同一性に関するDNAバーコーディングアッセイ
外来ウイルス因子微生物汚染
細胞を増殖させ調製
試験 MCB WCP EoPC 外来ウイルス因子検出のための28日間のin vitroアッセイ 6
(又は3バイアル + 70 mL上澄液使用)
同一性 + + + (Vero細胞、MRC-5及びCHO検出細胞株)
マイコプラズマ + + + In vivo外来ウイルス因子アッセイ:成体マウス、乳のみマウス、及び発育鶏卵を
細胞を増殖させ調製
無菌性 + + + 使用したICHトピックQ5A(R1)に従うバイオテクノロジー医薬品のウイルス安 8
(又は 1 × 10 7 cells/mLの23 mL上澄液使用)
In vitroアッセイ + + + 全性評価
In vivoアッセイ + - + レトロウイルス(テクニカルノートT2)
抗体試験 + - - Mus dunni 細胞との共培養とその後のMiCl S+L-アッセイによる 6 細胞を増殖させて得た生細胞
レトロウイルス感染性 + - + 異種指向性マウスのレトロウイルス検出
逆転写酵素 - - - 透過型電子顕微鏡(TEM)による200細胞プロファイル試験 4 細胞を増殖させて得た生細胞
電子顕微鏡 + - + 種特異的ウイルス
細胞を増殖させ調製
5ウイルスとマウス抗体作製テスト(MAP)、 10
種特異的試験 + - - (又は、1 x 10 7 cells/mLの8 mLの培養上清)
16ウイルス(EoPCには不要)
表1:GMP、GLP試験要件概要 リアルタイムPCRによるウシ、ブタウイルススクリーニング 2 1バイアル
リアルタイムPCRによるMVM検出 2 1バイアル
リアルタイムPCRによるベシウイルスの検出 2 1バイアル
表2:MCBとEoPCテスト。テクニカルノート1 – 6を参照のこと。
詳細は www.sartorius.com を
ご覧ください。
2 3
Page3
ワーキングセルバンク(WCB)テスト 遺伝的特性アッセイ
MCBに関する特性解析が広範囲に行われているため、WCB ICHガイドラインでは、適正なタンパク質の安定生産のために ザルトリウスは以下の遺伝的安定性アッセイを提供しており、
には限定的に試験を実施すべきです。 は挿入配列の安定性と完全性について特性解析を行うことが お使いの製品に最もふさわしいアプローチについてアドバイス
必要であると記載されています。 することができます。
一方で、MCBの代替として、WCBに対して包括的な試験を実
施する場合もあります。WCBに推奨されるテストの概要を図3 お客様の製品ライフサイクルの適切な時点で、MCB、WCB、
に示しています。 EoPCの同等性評価を遺伝子特性評価アッセイと並行して行
うことが推奨されています。
アッセイ内容 アッセイ期間(週) サンプルの要件 アッセイ内容 アッセイ期間(週) サンプルの要件
微生物汚染(テクニカルノートT1) セルバンクの1% 遺伝子解析
4 6 1バイアル
直接接種による無菌性試験(欧州薬局方最新版2.6.1無菌性、米国薬局方<71>) (最低2バイアル)* mRNAシーケンシングによる導入遺伝子配列(コード領域)確認
マイコプラズマテスト(欧州薬局方最新版2.6.7. マイコプラズマ及び DNAシーケンシングによる導入遺伝子近接領域確認 6 1バイアル
6 1バイアル
USP – NFマイコプラズマテスト、USP<63>最新版) 設計とバリデーション – リアルタイムPCRによる挿入遺伝子コピー数測定 5 -
同一性 テスト – リアルタイムPCRによる挿入遺伝子コピー数測定 2 1バイアル
2 最低 1 × 10 7 細胞を含む 1バイアル
細胞株同一性に関するDNAバーコーディングアッセイ サザンブロットによる制限酵素解析 6 1バイアル
外来ウイルス因子
細胞を増殖させ調製
外来ウイルス因子検出のため28日間のin vitroアッセイ 6
(又は3バイアル+70 mLの培養上清) 表4:遺伝的特性アッセイ
(Vero細胞、MRC-5及びCHO検出細胞株) テクニカルノートT7を参照。
表3:WCBテスト
*又はMCBに適格性認証されている最小量
4 5
Page4
統合型サービスの提供 世界に広がる施設
包括的ソリューションのための統合型サービスの一環として、 詳細情報は各サービスのカタログをご覧ください。
以下に関する総合的なソリューションを提供しています。
--- 細胞株開発- CHO GMPセルバンキング 詳細は www.sartorius.com を
CHO製品のテストと特性解析 ご覧ください。
バイオシミラーと新規のバイオ医薬品(NBE)の分析と
- 特性解析 Glasgow, UK
カスタムアッセイ設計 Göttingen, Germany
Ulm, Germany
Cambridge, USA
Pangyo, South Korea
テクニカルノート
T1. T4.
マイコプラズマと無菌性の検査におけるセルバンクサンプルのクオリ MAPテストは以下のウイルスを検出します。エクトロメリアウイルス、
フィケーションが、MCBでは1度要求されます。無菌性試験について リンパ球性脈絡髄膜炎ウイルス、ハンタウイルス、マウス肺炎ウイルス
は、最終的な凍結製剤に抗生物質が含まれている場合は別の膜ろ過 (PVM)、レオウイルス3型、マウス脳脊髄炎ウイルス、乳酸脱水素酵
法を行うことができます。 素ウイルス、センダイウイルス、マウス微小ウイルス(MVM)、マウスア
デノウイルス、マウスサイトメガロウイルス、マウス肝炎ウイルス、マウ
T2. スロタウイルス、ポリオーマウイルス、胸腺ウイルス、Kウイルス。
CHO細胞株には、内在性かつ欠損性の非感染性レトロウイルスが含
まれています。レトロウイルステストを行う際は多くのアプローチを取 T5.
り得ることができますが、すべての手順を実施する必要はありません。 作製又は開発時のいずれかの時期において親細胞がウシの血清又は
ブタのトリプシンに触れた場合、様々なウシおよびブタ特異的ウイル
■ a. 電子顕微鏡はレトロウイルス性粒子(出芽C型粒子、R型粒子、及
び嚢内A型粒子等)を視覚化する強力なツールです。 スの網羅的な試験を実施する必要があります。
T6.
■ b. PERTアッセイは酵素活性を検出するのに使用されています(ハ
ムスター細胞が内在性かつ欠損性の非感染性レトロウイルスを含 細胞増殖は、BioOutsourceで利用可能な手順および機器を用いた
んでいるため、結果は陽性となるはずです)。 標準条件で培養可能であるという前提のもと、実施することが可能
です。特殊な要件がある場合はザルトリウスまでご相談ください。
■ c. 検出用の細胞ベースの感染性アッセイは、検出されたウイルスが
感染性であるかどうかを判断します。感染性のウイルスが検出さ T7.
れると、細胞はヒト細胞株と共培養を行いヒト細胞への感染可能 アッセイ法の設計はその医薬品が単一の導入遺伝子から構成されて
性を判断します。標準的にTEMと感染性アッセイはCHOテスト いるのか、あるいは複数のインサート(抗体の重鎖と軽鎖等)から構
で実施されるものです。TEMでは結果が陽性となり感染性アッセ 成されているかによって異なります。
イでは陰性となることが予想されます。この場合はPERTは要求
されません。TEMでレトロウイルス様粒子が観察されなかった場 参考
合、PERTテストを行うこともできます。内在性ウイルスが存在する (1) ICH Q5A(R1)「ヒト又は動物株を用いて製造されるバイオテクノロジー応用医薬品の
ウイルス安全性評価」
ため、PERTテストでは結果が陽性となる可能性が高くなります。 (2) ICH Q5D「生物薬品(バイオテクノロジー応用医薬品|生物起源由来医薬品)製造
用基剤の由来、調製及び特性解析」
T3.
HAPテストは以下のウイルスを検出します。リンパ球性脈絡髄膜炎ウ
イルス(LCMV)、マウス肺炎ウイルス(PVM)、レオウイルス3型、セン
ダイウイルス、シミアンウイルス5型(SV5)。
6 7
Page5
お問い合わせ先
詳細については、www.sartorius.comをご覧ください。
ザルトリウス・ステディム・ジャパン株式会社
営業部
Phone : 03 6478 5201 | Fax : 03 6478 5495
www.sartorius.com
〒140-0001 東京都品川区北品川1-8-11 Daiwa品川Northビル4階
※製品仕様は予告なく変更される場合があります。
© 2021 Sartorius Stedim France S.A.S., Avenue de Jouques - Zone Industrielle Les Paluds - C.S. 71058, 13781 Aubagne Cedex, France
Status: 06 | 22 | 2021