1/6ページ
ダウンロード(406.7Kb)
本アプリケーションノートでは、超純水が細胞培養の調製を強化する方法をご紹介しています。
水はすべての細胞培養培地の主成分であるため、培地、バッファ、添加物の調製や加熱、冷却、洗浄、すすぎなど多くの補助的機能を担うために必要です。
そのため、水の品質が細胞培養実験の結果に重要な役割を果たします。
本アプリケーションノートでは、超純水が細胞培養の調製を強化する方法をご紹介しています。
※詳しくはPDF資料をご覧いただくか、お気軽にお問い合わせ下さい。
このカタログについて
| ドキュメント名 | 水は生命:超純水を用いた細胞培養 超純水製造装置 |
|---|---|
| ドキュメント種別 | 製品カタログ |
| ファイルサイズ | 406.7Kb |
| 登録カテゴリ | |
| 取り扱い企業 | ザルトリウス・ジャパン株式会社 (この企業の取り扱いカタログ一覧) |
この企業の関連カタログ

このカタログの内容
Page1
アプリケーションノート
2021年6月22日
キーワードまたはキーフレーズ:
超純水、細胞培養、培地と緩衝液の調製、
組換えタンパク質、モノクローナル抗体(mAb産生)、
治療用タンパク質の製造、PER.C6 EpCAM細胞
水が命:
細胞培養に用いる超純水
Anil Kumar Rathod1, Sheokant Diwakar1, Dr. Ashok Mundrigi1, Dr. Elmar Herbig2
1 Sartorius Stedim India Pvt. Ltd., Bangalore, India
2 Sartorius Lab Instruments GmbH & Co. KG, Goettingen, Germany
要約
水はすべての細胞培養培地の主成分であり、培地、緩衝液、添加物の調製や加熱、
冷却、洗浄、すすぎなど多くの補助的な機能を果たすためにも必要なものです。
そのため、水質は細胞培養実験の結果を得るうえで重要です。
詳細はwww.sartorius.comをご覧ください
Page2
はじめに 超純水製造装置
細胞培養に使用する水の汚染物質には、細菌、酵母、カビ この装置(図1)は、前処理水から微量の残留汚染物質を
など多くの種類があります。これらの汚染物質は通常、目視 取り除くことによって超純水を製造するように設計されていま
できるか光学顕微鏡によって検出できます。しかし、化学 す。超純水の製造には連続的な再循環と一定の流量が必要
物質や生物由来物質による汚染が培養細胞の増殖、形態、 です。圧力を制御するポンプシステムが、この動作を担います。
挙動に影響を及ぼすことがありますが、これらの物質は肉眼 装置の供給水口と採水口(精製水)の両方で水の導電率が
で確認できません。そのため、細胞培養に使用する水は 測定されています。
微生物を含まず、エンドトキシン、無機イオン(鉛、亜鉛な
どの重金属)、有機化合物(フミン酸類、タンニン、農薬など) 装置は2種類のカートリッジキットを取り付けた状態で動作し
を特に含有しないものでなければなりません。詳細について ます。これらのカートリッジには、それぞれ溶出物を少なく
は参考文献をご覧ください1, 2。水道水中の標準的な不純物と して高純度水を供給できるように開発された専用の活性炭
細胞培養に使用するための目標値の例を表1に示します。 吸着剤と混合床交換樹脂が充填されています。最終マイクロ
フィルターが通常採水口に取り付けられており、超純水を
パラメーター 水道水 細胞培養用 減少率(%) 採水する際にあらゆる粒子状物質や細菌を超純水から取り
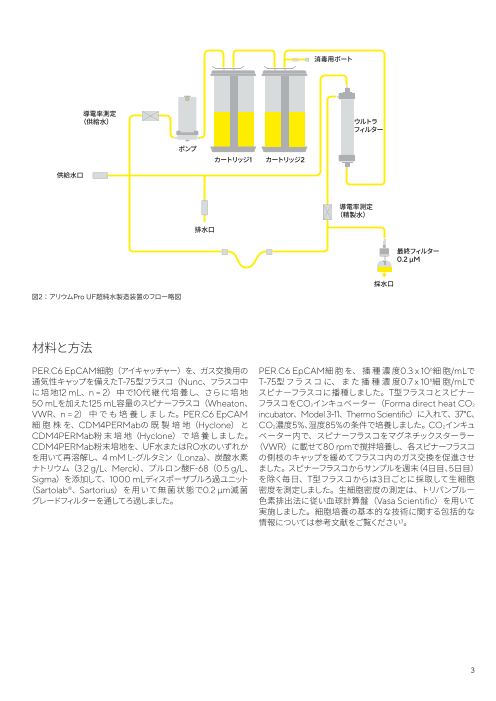
の水 除きます。水の精製について説明した大まかな工程を図2に
導電率(µS/cm) 50~ 900 0.2 99.95 示します。
カルシウム(mg/L) 20~ 150 < 0.01 > 99.99
以下に記載する試験のため、アリウムPro UF装置(前モデル、
ナトリウム(mg/L) 20~ 150 < 0.01 > 99.99 図1に示した現行のアリウムPro UF装置と同一の技術的
鉄(mg/L) 0.01~ 0.1 < 0.001 > 98 設計)への供給水を、アリウムRO逆浸透装置で前処理しま
重炭酸塩(mg/L) 30~ 300 < 0.01 > 99.99 した。この構成は、ラボでの小規模細胞培養に適した水の
塩化物(mg/L) 10~ 150 < 0.01 > 99.99 精製処理に関するWhiteheadの方法2に従ったものです。
この前処理装置については、本アプリケーションノートには
硫酸塩(mg/L) 1~ 100 < 0.01 > 99.98 これ以上記載されていません。
TOC(mg/L) 0.2~ 5 0.1 96
遊離塩素(mg/L) 0.1~ 0.5 < 0.01 > 97
細菌(CFU/100 mL) 100~ 1000 < 10 > 98
エンドトキシン(IU/mL) 1~ 10 < 0.1 > 98
濁度 0.1~ 2 < 0.01 > 99
表1:標準的な水道水中の不純物と細胞培養用の目標値2
今回の一連の試験の目的は、アリウムPro UFで製造した
超純水が問題を伴わずに細胞培養アプリケーションに簡単に
使用できるかどうかを評価することとしました。本研究では、
既製品のCDM4PERMab(Hyclone)培地を対照にして、
試験目的にアリウムPro UFで製造した超純水(UF水)
およびRO水をそれぞれ用いてCDM4PERMab(Hyclone)
粉末培地から調製した培地でPER.C6 EpCAM細胞を培養
しました。このアプリケーションノートに記載するRO水の
データは、現行のアリウムAdvanceシステムの前モデル
(アリウムRO)を使用して得ました。個々の培養結果を使用
してアリウムPro UFで製造した超純水がPER.C6 EpCAM
細胞の培養に適しているかどうかを評価しました。
一連の試験で使用したPER.C6細胞株はヒト網膜芽細胞に
由来するもので、組換えタンパク質やモノクローナル抗体
(mAb産生)の発現、治療用タンパク質やモノクローナル
抗体の製造にも今日使用されています。
図1:アリウムPro UF超純水製造装置
2
Page3
消毒用ポート
導電率測定
(供給水) ウルトラ
フィルター
ポンプ
カートリッジ1 カートリッジ2
供給水口
導電率測定
(精製水)
排水口
最終フィルター
0.2 µM
採水口
図2:アリウムPro UF超純水製造装置のフロー略図
材料と方法
PER.C6 EpCAM細胞(アイキャッチャー)を、ガス交換用の PER.C6 EpCAM細胞を、播種濃度0.3 x 106細胞/mLで
通気性キャップを備えたT-75型フラスコ(Nunc、フラスコ中 T-75型フラスコに、また播種濃度0.7 x 106細胞/mLで
に培地12 mL、n = 2)中で10代継代培養し、さらに培地 スピナーフラスコに播種しました。T型フラスコとスピナー
50 mLを加えた125 mL容量のスピナーフラスコ(Wheaton、 フラスコをCO2インキュベーター(Forma direct heat CO2
VWR、n = 2)中でも培養しました。PER.C6 EpCAM incubator、Model 3-11、Thermo Scientific)に入れて、37℃、
細胞株を、CDM4PERMabの既製培地(Hyclone)と CO2濃度5%、湿度85%の条件で培養しました。CO2インキュ
CDM4PERMab粉末培地(Hyclone)で培養しました。 ベーター内で、スピナーフラスコをマグネチックスターラー
CDM4PERMab粉末培地を、UF水またはRO水のいずれか (VWR)に載せて80 rpmで撹拌培養し、各スピナーフラスコ
を用いて再溶解し、4 mM L-グルタミン(Lonza)、炭酸水素 の側枝のキャップを緩めてフラスコ内のガス交換を促進させ
ナトリウム(3.2 g/L、Merck)、プルロン酸F-68(0.5 g/L、 ました。スピナーフラスコからサンプルを週末(4日目、5日目)
Sigma)を添加して、1000 mLディスポーザブルろ過ユニット を除く毎日、T型フラスコからは3日ごとに採取して生細胞
(Sartolab®、Sartorius)を用いて無菌状態で0.2 µm滅菌 密度を測定しました。生細胞密度の測定は、トリパンブルー
グレードフィルターを通してろ過しました。 色素排出法に従い血球計算盤(Vasa Scientific)を用いて
実施しました。細胞培養の基本的な技術に関する包括的な
情報については参考文献をご覧ください3。
3
Page4
結果と考察
対照のT型フラスコ(対照として既製培地で培養した細胞) 細胞が、既製培地中やUF水により再溶解した培地中で増殖
で得られた平均細胞密度は1.52 x 106細胞/mLで、これらの した細胞と比べて不健康に見えました。RO水により再溶解
対照細胞の平均生存率は95.23%でした(図3A)。T型 した培地でスピナーフラスコ培養した細胞では、既製培地中
フラスコを用いてUF水により再溶解した培地で培養した細胞 やUF水により再溶解した培地中で培養した細胞と比べ、生存
では、平均細胞密度が1.73 x 106細胞/mLで、95.7%の平均 率が急速に低下しました。このような生存率の低下は、T型
生存率が得られました。これらの結果と比較して、RO水に フラスコで培養した細胞では認められませんでした。スピナー
より再溶解した培地で培養した細胞では、1.68 x 106細胞/mLの フラスコ内で生存率が急速に低下したのは、RO水中にエン
平均細胞密度と95.59%の生存率が得られました(図3A)。 ドトキシンや無機塩類が存在し、これらが細胞の増殖と生存
率に影響を及ぼした可能性があります。しかし、エンドトキ
シンと無機塩類によるこれらの有害な影響は、T型フラスコ
A. T型フラスコで培養した細胞の増殖曲線
2.5 100 などによる静置培養(小規模培養)では認められませんでし
た。静置培養の場合、培地中のO2濃度によって細胞の増殖
2 80 が制限されるためですが、エンドトキシンや無機塩類の濃度
1.5 60 による増殖の制限はありません(スピナーフラスコ中での
培養と比べると、T型フラスコ中の培養では典型的な増殖
1 40 曲線が観察されません)。
0.5 20
実際の影響は、スピナーフラスコ中で培養することでより
0 0
1 2 3 4 5 6 7 8 9 10 高い細胞密度に達し、O2が増殖の制限要因にならない場合
継代数 のみに認められます。高い細胞密度に到達できるスピナー
UF水の細胞密度 対照の細胞密度 RO水の細胞密度 フラスコ培養では、RO水により再溶解した培地中により
UF水の細胞生存率 対照の細胞生存率 RO水の細胞生存率 高い濃度のエンドトキシンと無機塩類の影響として、対照
(既製培地)やUF水により再溶解した培地のサンプルから得
た値よりも増殖速度が低下(低い細胞密度と低い生存率)
B. スピナーフラスコで培養した細胞の増殖曲線
8 します。これらの結果は、抗体産生(mAb)の実験でも
7 100 確認されています。スピナーフラスコを用いてUF水により
6 80 再溶解した培地で培養した細胞のmAb産生量(図4)は
5 0.84 mg/mL(8日目の例)であるため、対照のメーカー
4 60 既製培地(0.71 mg/mL)やRO水により再溶解した培地
3 40 サンプルにより得られたmAb産生量(0.42 mg/mL)より
2
20 も多くなります。T型フラスコ中での細胞の抗体産生能(mAb
1 産生量)は測定しませんでした。抗体の量が少な過ぎたため、
0 0
0 1 2 3 4 5 6 7 8 そのような低値を確実に比較しようとしても統計的に無意味
日 でした。
UF水の細胞密度 対照の細胞密度 RO水の細胞密度
UF水の細胞生存率 対照の細胞生存率 RO水の細胞生存率
図3:(A)T型フラスコ中でのPER.C6 EpCAM細胞株の増殖曲線 スピナーフラスコでの抗体産生
(B)スピナーフラスコ中でのPER.C6 EpCAM細胞株の増殖曲線 1
0.9
0.8 対照のmAb
別の実験として、PER.C6 EpCAM細胞株を、既製培地(対照)、 0.7 UF水のmAb
0.6 RO水のmAb
UF水により再溶解した培地、RO水により再溶解した培地を 0.5
それぞれ加えたスピナーフラスコ中で培養しました(図3B)。 0.4
培養6日目に対照のスピナーフラスコで得られた最大細胞 0.3
0.2
密度は、5.42 x 106細胞/mL、生存率は88.47%でした。また、 0.1
UF水のスピナーフラスコでは最大細胞密度6.24 x 106細胞/ 0
0 1 2 3 4 5 6 7 8
mLと生存率88.55%が得られ、RO水のスピナーフラスコで 日
は最大細胞密度4.60 x 106細胞/mLと生存率89.85%が得ら
れました(図3B)。RO水のスピナーフラスコ中の細胞を
図4:UF水により再溶解した培地(UF水のmAb)、既製培地(対照の
mAb)、RO水により再溶解した培地(RO水のmAb)をスピナーフラスコ
顕微鏡観察すると、RO水により再溶解した培地中で増殖した に入れて培養した細胞の抗体産生
4
細胞密度(106細胞/mL) 細胞密度(106細胞/mL)
生存率(%) 生存率(%)
mAb(mg/mL)
Page5
結論 参考文献
上記の結果から、市販の既製培地の代わりに、UF水により 1. ASTM Standard Guide for Bio-Applications Grade Water
再溶解した乾燥培地(CDM4PERMab培地)がPER.C6 D 5196-06 (2018). https://www.astm.org/Standards/
EpCAM細胞株の培養用途に適していることが明確に示され D5196.htm
ました。UF水により再溶解した培地で培養したPER.C6 2. Whitehead, P. (2007). Water Purity and Regulations.
EpCAM細胞株の増殖特性は、対照に用いたCDM4PERMab Stacey, G.N., & Davis, J. (Eds.) Medicines from Animal Cell
既製培地で培養したPER.C6 EpCAM細胞株の増殖特性に Culture. John Wiley & Sons, Ltd.
類似するものでした。 3. Freshney, I.R. (2010). Culture of Animal Cells: A Manual of
Basic Technique and Specialized Applications, Sixth
さらに、培養実験をスピナーフラスコで実施した場合に、 edition. John Wiley & Sons, Inc.
UF水により再溶解した培地で培養した細胞株サンプルでは、 4. Schmidt, K. & Herbig, E. (2012). Weniger ist mehr—
RO水により再溶解した培地で培養した細胞株サンプルと Quantitative Endotoxinbestimmung von Reinstwasser.
比較して増殖が促進することを確認しました。この場合には、 Laborpraxis, 5, 36. Jhg.
通常、細胞密度がより高くなり、O2が増殖の制限要因になり
ません。その結果、RO水中のより高い濃度のエンドトキシン
や無機塩類が細胞増殖の低下を引き起こすと結論付けました。 謝辞
これらの結果は、スピナーフラスコ中で培養したPER.C6 PER.C6細胞株の写真をご提供いただき、さらに技術面の
EpCAM細胞株におけるmAbの産生でも確認され、裏付け 考察を示していただいたSartorius-Stedim Biotech GmbH
られました。PER.C6細胞株によるmAb産生量は、アリウム (ドイツ、ゲッティンゲン)のAlexander Tappe博士とYvonne
Pro UF超純水により再溶解した培地サンプルで最高値とな Martin博士に感謝を表します。
り、次が対照(既製培地)による値でした。これらの値は、
mAb産生量が低下したRO水培地サンプルの値と異なるも 初版:G.I.T. Laboratory Journal Europe 9-10,
のでした。 Volume 16
したがって、アリウムPro UF装置から得た超純水がPER.C6
EpCAM細胞の培養に非常に適していると結論付けます。そ
の理由として、この水精製装置は無機イオン、有機化合物な
どの不純物の含有量を最小限に抑え、特にエンドトキシンを、
別の実験で確認されたような極めて低い濃度に低減できるこ
とが挙げられます4。
5
Page6
ザルトリウス・ジャパン株式会社
東京本社 名古屋営業所 大阪営業所
〒140-0001 〒461-0002 〒532-0003
東京都品川区北品川1-8-11 名古屋市東区代官町35-16 大阪市淀川区宮原4-3-39
Daiwa 品川North ビル4 階 Phone: 03 6478 5204
Phone: 03 6478 5200 Fax: 03 6478 5494 Fax: 03 6478 5497
Email: hp.info@sartorius.com
F or further information,
visit www.sartorius.com
掲載されている内容は、予告なく変更される場合がありますことをあらかじめご了承ください。
Copyright Sartorius Lab Instruments GmbH & Co. KG. All Rights Reserved. Printed
in the EU or US on paper bleached without chlorine.
Version 1 | 06 | 2021