1/13ページ
ダウンロード(745.2Kb)
実輸送環境の再現、バイオ医薬品・試薬等の輸送安定性試験に最適
【掲載内容】
◆輸送環境試験装置 TRE-200
医療分野の新規則
輸送試験と実輸送との乖離
製品コンセプト
製品仕様
◆輸送環境試験装置 TRE-100
医薬品市場
大阪大学・内山研究室との共同研究
製品コンセプト
製品仕様
◆詳細はカタログをダウンロードしご覧いただくか、お気軽にお問い合わせ下さい。
このカタログについて
| ドキュメント名 | 輸送環境試験装置のご紹介【 輸送環境試験装置 TRE-200 / TRE-100】 |
|---|---|
| ドキュメント種別 | 製品カタログ |
| ファイルサイズ | 745.2Kb |
| 登録カテゴリ | |
| 取り扱い企業 | 丸文通商株式会社 (この企業の取り扱いカタログ一覧) |
この企業の関連カタログ

このカタログの内容
Page1
輸送環境試験装置
TRE-100/TRE-200
2019年5月30日
エスペック株式会社
1
Page2
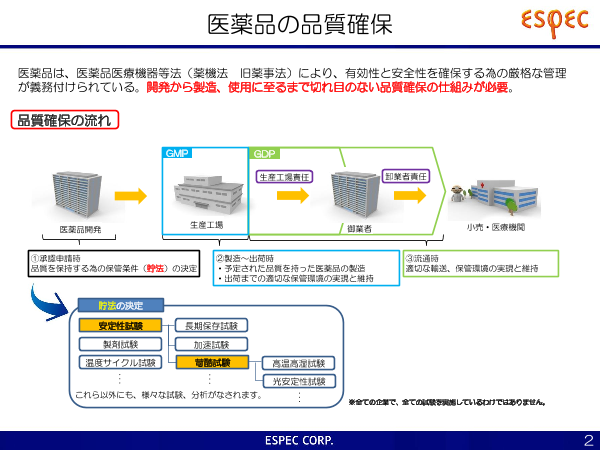
医薬品の品質確保
医薬品は、医薬品医療機器等法(薬機法 旧薬事法)により、有効性と安全性を確保する為の厳格な管理
が義務付けられている。開発から製造、使用に至るまで切れ目のない品質確保の仕組みが必要。
品質確保の流れ
GMP GDP
生産工場責任 卸業者責任
生産工場
医薬品開発 御業者 小売・医療機関
①承認申請時 ②製造~出荷時 ③流通時
品質を保持する為の保管条件(貯法)の決定 ・予定された品質を持った医薬品の製造 適切な輸送、保管環境の実現と維持
・出荷までの適切な保管環境の実現と維持
貯法の決定
安定性試験 長期保存試験
製剤試験 加速試験
温度サイクル試験 苛酷試験 高温高湿試験
・ ・
・ ・
・ ・ 光安定性試験
これら以外にも、様々な試験、分析がなされます。 ・・
・ ※全ての企業で、全ての試験を実施しているわけではありません。
2
Page3
GDPと輸送時のリスク①
GDP(Good Distribution Practice:適正流通基準)★ガイドライン 2018年12月28日発出
医薬品は、市場に出荷されてから後も製造時の状態を維持し、“完全性※”を保たなければならない。
※品質の劣化、改ざん、破壊のないこと
輸送時のリスクアセスメントが今まで以上に重要。
リスク① タンパク質の凝集
輸送時の温度、振動、落下等によるタンパク質凝集体生成が発生[1]
従来の評価試験では単独ストレスしか確認できない(≠実輸送環境)
輸送損失コストが非常に高い (1回当たりの輸送金額は約1億円)
容器 (バイアル瓶、シリンジ等) もタンパク質の凝集に影響[2]
落下・振とう複合ストレスによる凝集体生成経路に関するモデル[1]
[1] 鳥巣 哲生、“落下・振とう複合ストレスによるバイオ医薬品の凝集に関する研究”、大阪大学 博士論文、2018年
[2] 内山 進、“抗体医薬などのバイオ医薬品の物理化学的評価”、薬学雑誌、p.443-448、2016年
3
Page4
(参考)大阪大学 内山研究室との共同研究
2019年4月から、エスペックは大阪大学 内山研究室と共同研究を開始しています
テーマ:「バイオ医薬品・試薬等の輸送安定性試験法」
期間:2019年4月~2020年3月
現状:標準的な輸送安定性試験法がなく、品質評価上の課題
目的:広く利用可能なバイオ医薬品等の輸送安定性試験法の確立
内容:・振とう機、摩損度試験機等を用いたストレス試験に加えて、実際の輸送データ
に基づいたストレス試験の実施
・簡便かつ実際の輸送データと関連付けが可能な安定性評価
・試験条件の見出し
内山先生
※内山 進(2019)「高品質で安全な抗体医薬のための高度分析」,『生産と技術』,第71巻 第1号,p.73-74
4
Page5
輸送環境試験装置 TRE-100 製品仕様
一部の試薬等でも、低温環境下での振動によりコロイド凝集反応が起きることがわかっています。
輸送環境試験装置 TRE-100では、エスペックの小型環境試験器に低温領域での動作が可能な
バイオクラフト社製の振とう機を組み合わせることで、このような実輸送に近い環境での評価を行えます。
導入メリット
試験時間の短縮
・従来の試験機では、別々に評価していた零度以下の温度試験と振とう試験を同時に行える。
3つの「可能」
・輸送過程を低コストで評価(再現)可能。
・低温環境課での振とう試験による凝集体の生成が可能。
・外部コントローラで、温度運転中の振とう制御が可能。
恒温槽
(弊社SU-642) 製品仕様
温度範囲 -10℃~65℃
動作 水平回転
振動往復数 14~280回往復/分
振幅巾 40mm
振とう機 最大搭載量 1.5kg
(バイオクラフト社製BC-740) 振とう機外部コントローラ
5
Page6
輸送環境試験装置 TRE-100 設置仕様
TRE-100外観図
TRE-100
幅 540mm
奥行き 921mm
高さ 730mm
振とう機・恒温槽
電源
それぞれ必要
振とう機 恒温槽
電圧 AC100V 1相 AC100V 1相
周波数 50/60Hz 50/60Hz
電流 5A 17.5A
使用温度 -10~65℃ 5~35℃
6
Page7
GDPと輸送時のリスク②
リスク② 実輸送時との損傷再現率の乖離
現在、多く実施されているJIS/ISO規格の輸送試験では輸送時の損傷再現率は10%以下でしかない。
①規格試験の振動方向は単軸方向に限定、実輸送は3軸同時振動が発生。
②特定の振動周波数が加わると、 “共振”が発生することがある。
③トラック輸送などでは、右左折による貨物が左右へ移動しようとする力が加わる。
3軸同時振動が発生
40Hz以下の低周波数が主
※アイデックス(株)様HPより:名神高速の桂川PAからアイデックス社本社(八王子市)までの輸送振動計測
現在の輸送試験方法に関する課題
温度と振動の影響を別々で評価するため、試験時間が長い
温度と振動の複合環境試験装置はあるが、大型で高価格
実輸送での評価は交通事情による結果がバラつき、原因の特定が困難
7
Page8
輸送環境試験装置 TRE-200 製品仕様
エスペックの恒温槽と損傷再現率90%以上、トラック輸送1000㎞相当を20分間で再現できるアイデッ
クス社製輸送包装試験機を組み合わせることで、医薬品、医療機器、化粧品、食品等、様々な分野の輸送
(特にトラック)における環境因子(温度・振動)の影響を適切に評価することが可能になります。
導入メリット
業務の最適化
正しい実環境の再現は、正しいリスクの把握に繋がり、業務の最適化が可能。
・梱包、容器、包装の耐久性評価 ・温度、振動の管理体制構築 ・品質確保のための輸送基準構築
低コスト、省スペース
実輸送環境の再現に必要な最低限のスペック、機器構成に絞り込むことで低価格小型化を実現。
温調用恒温槽(弊社製)
試験ボックス
製品仕様
温度範囲 -30℃~70℃
振動加速度 98m/s2 (10G)
周波数範囲 10~67Hz
振動方向 3軸同時
Manual, Random,
操作 Sweep,
Transportation
振幅範囲 0~1.7mm pp
輸送包装試験機:
アイデックス社BF-50UT 最大搭載量 40kg
8
Page9
輸送環境試験装置 TRE-200 設置仕様
TRE-200外観図
TRE-200
幅 1648mm
奥行き 888.5mm
高さ 1356mm
振動機・恒温槽
電源
それぞれ必要
輸送包装試験機 温調用恒温槽
電圧 AC200~240V 3相 AC200V 3相
周波数 50/60Hz 50/60Hz
電流 2A以下 14A
使用温度 0~40℃ 0~40℃
9
Page10
医薬品物流倉庫
保管施設について
GDPでは、卸売販売業者等に対して、医薬品の適切な保管及び流通を保証できるように、適切かつ十分
な施設、設備及び機器を保有することが求められています。特に施設は清潔で乾燥し、許容可能な温度
範囲に維持する必要があります。
医薬品の完全性と温度管理
医薬品の完全性 品質の確保 温度マッピング :分布測定(バリデーション)
流通過程の適正管理 温度モニタリング :ワーストポイントを常時監視
偽造医薬品の流入防止 温度逸脱時対応 :通報体制、対処の手順化
CWHやビルドイン
CWHにはないビルドインの特長
必要な能力に応じた様々な保管環境の構築が可能
・必要な温度範囲や湿度制御の有無などにより、要望通りの保管環境が構築可能。
・超低温や低湿など特殊施工(オーダーメイド)にも幅広く対応可能。
異形大型寸法にも対応
・標準仕様の12型を超える大容量化、天井高の変更など、
あらゆる保管施設への対応が可能。
10
Page11
(参考)医薬品を取り巻く規制等の変遷
医薬品の製造販売に必要な新薬承認審査の基準が、各地域の規制当局でバラバラ。
ドラッグラグの問題など、いい薬の自由な相互乗り入れができない 。
ICH(日米EU医薬品規制調和国際会議)の合意を受けて、
1994年4月、当時の厚生省より安定性試験ガイドラインが告示される。
2013年4月、後発医薬品の数量シェアを2018年3月末迄に60%以上にすると厚労省が公表。
新薬に対する後発医薬品の同等性を明確にする為、長期保存試験の必要性が増加。
2013年8月、PIC/S加盟を踏まえ、改正GMP省令を厚労省が発行。
・原材料メーカー(サプライヤー)の管理 :製品品質、安定供給。
・製品、原薬の安定性モニタリングの実施 :安定性試験を継続的にモニター。
・参考品(必要と考えられる原材料含む)の保管:有効期間+1年。製造販売承認書に明記の条件か成行き室温。要温度モニタリング
等
2014年7月、日本が45番目のPIC/S加盟国になる。
2014年11月、改正薬事法(医薬品医療機器等法)が施行。
一般用医薬品のネット販売が緩和される。 ※2018年9月現在:
72.6%
2015年6月、後発医薬品の数量シェアを2017年央に70%以上、
2018年度~2020年度末までの間のなるべく早い時期に80%以上にするとの閣議決定。
2016年8月、厚労省より事務連絡が発出。従来GMP適応外だった医薬品添加剤についても、
自主基準を策定し、品質確保を図ることとなる。
2018年12月28日、日本版GDPガイドラインが厚労省より発出。
輸送中の温度管理がより厳格に求められる。
11
Page12
(参考)日本版GDPの注目点
本ガイドラインに対する質疑応答の中で、下記のように不明点の明確化及び指針が示された。(一部抜粋)
①【Q】再生医療等製品については、適用範囲に含まれないのか。
【A】含まれない。
②【Q】本ガイドラインの原則要件を充足できなければ、業の許可更新ができないのか。
【A】GMP用例等のような拘束力があるものではない。業許可取得や更新の要件ではない。
③【Q】輸送に関するリスクマネジメントは何を行えばよいのか。
【A】輸送・配送、積み込み・積み替え、輸送中の一時保管、返品等のプロセスに対してリスク分析
を実施し、品質リスクマネジメント(ICH Q9)に従った手順で検討を行うことが考えられる。
④【Q】具体的なマッピングのポイント、温度データの取得間隔(時間)などの具体例を示してほしい。
【A】“Temperature mapping of storage areas,Technical supplement to WHO Technical
Report Series,No.961,2011”等が参考になる。
⑤【Q】医薬品を保管する環境管理として温度と湿度があるが、今後湿度のモニタリングやコントロールを
求められる可能性はあるのか。
【A】湿度についてはコントロールまでは求められないものの、保存される医薬品の品質特性や包装形態
等を考慮し、必要に応じてモニタリングを行うことが望ましい。
⑥【Q】輸送中の許容可能な温度を証明するために、配送毎に温度ロガーの設置が求められているか。
【A】その製品に求められる温度条件や製品の特性等を考慮してリスク評価を行い、適切に判断すること。
⑦【Q】輸送時の温度逸脱が生じた場合の品質保証上の方法について示してほしい。
【A】科学的根拠(安定性データ等)に基づき、製品ごとに適切に設定することが求められる。
⑧【Q】輸送時の一時的温度上昇の発生は避けられないと考えるが、許容される範囲を示してほしい。
【A】一時的な温度上昇が発生した際の状況を確認し、製品の品温への影響、当該医薬品の温度安定性
や、一時的温度上昇の許容度等を勘案する必要がある。製品の品質に関する情報を有しているのは
製造販売業者であるので、個々の製造販売業者で製品ごとに許容範囲を設定することが望ましい。
12
Page13
以上
13